Bước 2: Tìm số mol nguyên tử từng nguyên tố trong một mol hợp chất rồi quy về khối lượng.
Bạn đang xem: Các công thức hóa học từ lớp 8 đến lớp 12 bạn cần phải nhớ
Bước 3: Tìm thành phần tỷ lệ các yếu tắc trong phù hợp chất.
Ví dụ: Xác định thành phần xác suất theo khối lượng của các nguyên tố tất cả trong hợp chất KNO3
Lời giải
+ $M_KNO_3~$= 39 + 14 + 16.3 = 101 gam/mol
+ trong 1 mol KNO3 có: 1 mol nguyên tử K; 1 mol nguyên tử N và 3 mol nguyên tử O
$+) ext \%K=frac39.100\%101=38,6\%$
$+) ext \%N=frac14.100\%101=13,8\%$
$+) ext \%O=frac16.3.100\%101=47,6\%$ hoặc %O=100% - (38,6% + 13,8%) = 47,6%
II. Khẳng định công thức hoá học của thích hợp chất khi biết thành phần những nguyên tố
Bước 1: Tìm trọng lượng mỗi nhân tố có trong một mol đúng theo chất.
Bước 2: Tìm số mol nguyên tử từng nguyên tố trong 1 mol hòa hợp chất.
Bước 3: Lập công thức hóa học tập của phù hợp chất.
Ví dụ: Một hơp chất bao gồm thành phần những nguyên tố là 40%Cu; 20% S và 40%O. Hãy xác minh công thức hoá học của hợp chất (biết cân nặng mol là 160)
Lời giải
- trọng lượng của từng nguyên tố trong một mol hợp hóa học là:
m
Cu = $frac40.160100 ext=64 ext gam$
m
S = $frac20.160100=32 ext gam$
m
O = $frac40.160100=64 ext gam$
- Số mol nguyên tử của mỗi nguyên tố vào một mol hợp chất là:
n
Cu = $frac6464$ = 1 mol
n
S = $frac3232$ = 1 mol
n
O = $frac6416$ = 4 mol
Vậy cách làm hoá học tập của hợp hóa học là: Cu
SO4
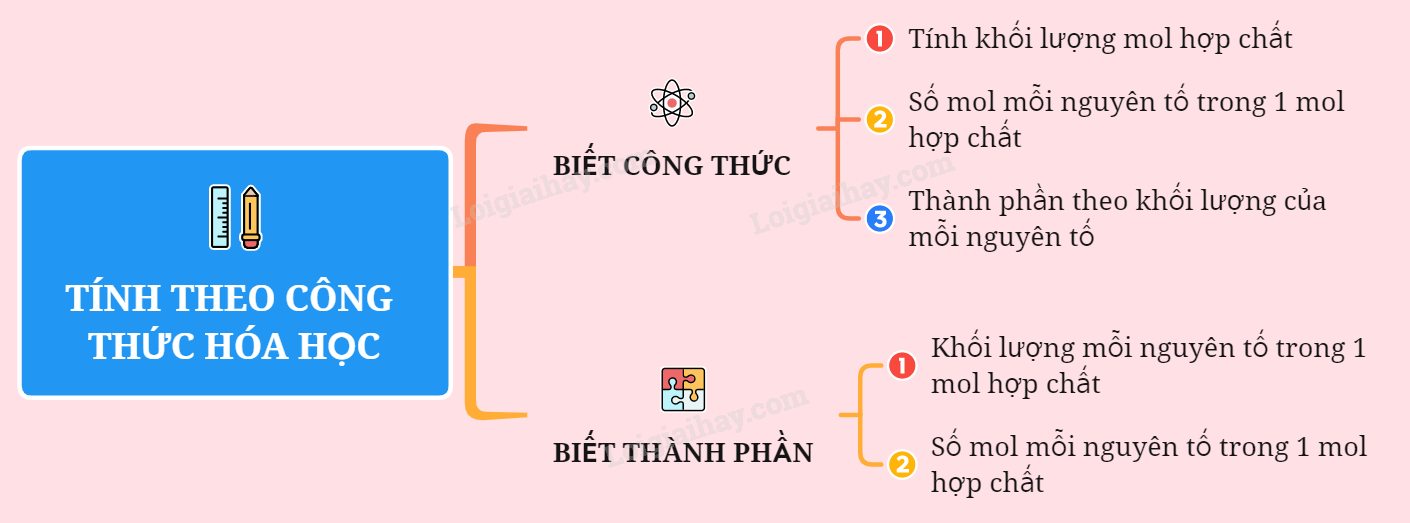
Sơ đồ tứ duy: Tính theo cách làm hóa học


Chia sẻ
Bình chọn:
4.3 trên 54 phiếu
Bài tiếp theo

Luyện bài bác Tập Trắc nghiệm Hóa lớp 8 - coi ngay
Báo lỗi - Góp ý
Tham Gia Group dành cho 2K10 phân tách Sẻ, Trao Đổi tư liệu Miễn Phí
 |  |  |
 |  |  |
TẢI app ĐỂ coi OFFLINE


Bài giải bắt đầu nhất
× Báo lỗi góp ý
Vấn đề em gặp mặt phải là gì ?
Sai chủ yếu tả
Giải nặng nề hiểu
Giải không đúng
Lỗi không giống
Hãy viết chi tiết giúp Loigiaihay.com
gửi góp ý Hủy bỏ
× Báo lỗi
Cảm ơn các bạn đã áp dụng Loigiaihay.com. Đội ngũ giáo viên cần nâng cao điều gì để bạn cho nội dung bài viết này 5* vậy?
Vui lòng để lại thông tin để ad hoàn toàn có thể liên hệ với em nhé!
Họ cùng tên:
giữ hộ Hủy vứt
Liên hệ cơ chế






Đăng ký kết để nhận giải mã hay cùng tài liệu miễn phí
Cho phép loigiaihay.com giữ hộ các thông báo đến các bạn để nhận ra các giải thuật hay cũng tương tự tài liệu miễn phí.
Danh sách bí quyết hóa học rất đầy đủ nhất từ lịch trình hóa học lớp 8 như phương pháp tính số mol, công thức tính mật độ chất, bí quyết tính thể tích . . . Những bí quyết này sẽ giúp đỡ học sinh áp dụng giải bài bác tập một bí quyết dễ dàng, nhanh lẹ . . . Khi vẫn học thuộc. Bảng công thức này còn có những gì mà lại diệu kỳ mang đến thế, hãy cùng cửa hàng chúng tôi tìm gọi trong nội dung bài viết dưới phía trên nhé.
Công thức hóa học mang đến bâi giờ chúng ta có thể hiểu theo 2 cách khác nhau đó chính là công thức biểu mô tả nguyên tố bao gồm trong chất nào kia và cách làm hóa học còn có ý nghĩa sâu sắc đó chính là những phương pháp liên quan đến các lượng chất sử dụng để giám sát và đo lường trong hóa học.Do vậy, trong bài viết này các em cần phải biết được công ty chúng tôi đang trình diễn những công thức liên quan đến lượng chất áp dụng để đo lường trong hóa học mà không trình bày công thức chất hóa học của chất nào đó.Khi nhắc tới công thức hóa học, chúng ta sẽ chạm mặt ngay công thức đầu tiên đó đó là công thức tính số mol chất, phương pháp tính khối lượng, cách làm tính nồng độ hóa học . . . Và còn nhiều phương pháp khác nữa. Vày vậy, công ty chúng tôi tổng vừa lòng bảng công thức hóa học tương đối đầy đủ từ lớp 8, lớp 9, lớp 10, lớp 11, lớp 12 sau đây giúp các em dễ tìm kiếm, dễ vận dụng hơn.
Bảng bí quyết hóa học | |||
Công thức tính số mol | |||
| STT | Công thức hóa học | Diễn giải | Bài tập |
| 1 | n = m/M ( | n là số mol chất - Đơn vị: Mol.m là khối lượng - Đơn vị: gam.M là khối lượng mol - Đơn vị: gam/mol. | |
| 2 | n = V/22,4 ( | n là số mol chất ở ĐKTC - Đơn vị: Mol.V là thể tích hóa học khí nghỉ ngơi ĐKTC - Đơn vị: Lít.1 mol khí bất kể ở ĐKTC hoàn toàn có thể tích là 22,4 lít. | |
| 3 | n = centimet x Vdd( | n là số mol chất - Đơn vị: Mol.CMlà nồng độ mol - Đơn vị: mol/l.Vddlà thể tích của hỗn hợp - Đơn vị: l | |
| 4 | n = A/N ( | n là số mol chất - Đơn vị: Mol.A là số nguyên tử hoặc phân tử.N là số Avôgađrô (N =6.10-23) | |
| 5 | n = (P.V)/(R.T) ( | n là số mol chất - Đơn vị: Mol.P là áp suất - Đơn vị: atm V là thể tích - Đơn vị: Lit R là hằng số - giá chỉ trị: R =0,082T là ánh sáng - giá trị:273+to C - Đơn vị: Độ Kelvin | |
Công thức tính khối lượng | |||
| 1 | m = n . M | n là số mol chất - Đơn vị: Mol.m là khối lượng - Đơn vị: gam.M là khối lượng mol - Đơn vị: gam/mol. | |
| 2 | mct = mdd - mdm | mctlà cân nặng chất tanmddlà cân nặng dung dịchmdmlà khối lượng dung môi | |
| 3 | mct=(mdd.100):C% | mctlà cân nặng chất tanmddlà cân nặng dung dịch C% là nồng độ hóa học tan tất cả trong dung dịch. | |
| 4 | mct=(mdm.S):100 | mctlà khối lượng chất tan.mdmlà khối lượng dung môi.S là độ tan của chất tan. | |
Công thức tính cân nặng dung dịch | |||
| 5 | mdd=(mct.100)C% | mdd là khối lượng dung dịchmct là trọng lượng chất tan C% là nồng độ phần trăm | |
| 6 | mdd= mct+ mdm | mdd là Khối lượng dung dịchmct là Khối lượng chất tanmdm là Khối lượng dung môi | |
| 7 | mdd = V.D | mdd là Khối lượng dung dịch.V là thể tích.D là cân nặng riêng. Xem thêm: Cách Xoay Dọc 1 Trang Giấy Trong Word 2010, 2003, 2007 | |
Công thức tính độ đậm đặc dung dịch | |||
| 8 | C%=(mct.100)/mdd | C% là nồng độ % của dung dịch.mctlà khối lượng của chất tan.mddlà trọng lượng của dung dịch. | |
| 9 |
Tổng số điểm của nội dung bài viết là: 41 vào 9 tiến công giá
4.6 - 9 phiếu thai Bảng cách làm hóa học vừa đủ nhất Xếp hạng: 4.6 - 9 phiếu bầu 5