Đề thi lớp 1
Lớp 2Lớp 2 - liên kết tri thức
Lớp 2 - Chân trời sáng tạo
Lớp 2 - Cánh diều
Tài liệu tham khảo
Lớp 3Lớp 3 - liên kết tri thức
Lớp 3 - Chân trời sáng tạo
Lớp 3 - Cánh diều
Tài liệu tham khảo
Lớp 4Sách giáo khoa
Sách/Vở bài bác tập
Đề thi
Lớp 5Sách giáo khoa
Sách/Vở bài xích tập
Đề thi
Lớp 6Lớp 6 - liên kết tri thức
Lớp 6 - Chân trời sáng sủa tạo
Lớp 6 - Cánh diều
Sách/Vở bài xích tập
Đề thi
Chuyên đề và Trắc nghiệm
Lớp 7Lớp 7 - liên kết tri thức
Lớp 7 - Chân trời sáng sủa tạo
Lớp 7 - Cánh diều
Sách/Vở bài tập
Đề thi
Chuyên đề & Trắc nghiệm
Lớp 8Sách giáo khoa
Sách/Vở bài xích tập
Đề thi
Chuyên đề và Trắc nghiệm
Lớp 9Sách giáo khoa
Sách/Vở bài xích tập
Đề thi
Chuyên đề và Trắc nghiệm
Lớp 10Lớp 10 - kết nối tri thức
Lớp 10 - Chân trời sáng tạo
Lớp 10 - Cánh diều
Sách/Vở bài tập
Đề thi
Chuyên đề và Trắc nghiệm
Lớp 11Sách giáo khoa
Sách/Vở bài tập
Đề thi
Chuyên đề và Trắc nghiệm
Lớp 12Sách giáo khoa
Sách/Vở bài xích tập
Đề thi
Chuyên đề & Trắc nghiệm
ITNgữ pháp giờ đồng hồ Anh
Lập trình Java
Phát triển web
Lập trình C, C++, Python
Cơ sở dữ liệu

Công thức chất hóa học 11Chương 1: Sự năng lượng điện li
Chương 2: Nitơ - Photpho
Chương 3: Cacbon - Silic
Chương 4: Đại cưng cửng về chất hóa học hữu cơ Chương 5 : Hiđrocacbon no
Chương 6 : Hiđrocacbon không no
Chương 7: Hiđrocacbon thơm. Mối cung cấp hiđrocacbon thiên nhiên. Hệ thống hóa về hiđrocacbon
Chương 8: Dẫn xuất halogen - Ancol - Phenol
Chương 9: Anđehit - Xeton - Axit cacboxylic
Công thức bảo toàn số mol links pi hay tuyệt nhất - chất hóa học lớp 11
Trang trước
Trang sau
Công thức bảo toàn số mol link pi tuyệt nhất
Với loạt bài Công thức bảo toàn số mol liên kết pi hay tốt nhất Hóa học lớp 11 sẽ giúp học sinh nắm rõ công thức,từ đó bài bản ôn tập kết quả để đạt công dụng cao trong những bài thi môn chất hóa học 11.
Bạn đang xem: Công thức tính liên kết pi
Bài viết bí quyết bảo toàn số mol links pi xuất xắc nhất tất cả 4 phần: Công thức, chúng ta nên biết, không ngừng mở rộng và bài bác tập minh họa vận dụng công thức trong bài có lời giải chi tiết giúp học sinh dễ học, dễ dàng nhớ công thức bảo toàn số mol link pi hay độc nhất vô nhị Hóa học tập 11.

Trong công tác hóa học, chủ thể bảo toàn link pi trong phản ứng cộng là phần kiến thức đặc biệt quan trọng giúp học sinh giải được nhiều bài toán khó.Bài viếtdưới đây,đưa ra phương pháp chung nhằm giải nhanh các bài tập hiđrocacbon ko no công dụng với hiđrovàbrom. Bài viết sẽ khiến cho bạn đọcnâng cao năng lực giải bài tập cấp tốc và thiết yếu xácthôngtiếp cận, làm cho quen với phương thức này để đem lại tác dụng học tập cao hơn.
1. Cách làm bảo toàn số mol liên kết pi
Đối với những bài toán cùng Br2, H2 vào hiđrocacbon không no thì nên vận dụng bảo toàn số mol liên kết π .
Hiđrocacbon ko no, mạch hở có k liên kết pi có công thức là Cn
H2n + 2 - 2k thì:
+ Số mol liên kết = nphân tử hidrocacbon . Số liên kết π = nphân tử hidrocacbon .k
+ Số mol link
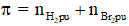
Cách tính số link π so với hiđrocacbon không no, mạch hở Cx
Hy là:
Số liên kết
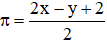
2. Bạn nên biết
Liên kết song C=C bao gồm một liên kết σ cùng một links π; links ba C ≡ C tất cả một links σ cùng hai links π. Link π yếu bền hơn liên kết σ nên những anken, ankin tiện lợi tham gia phản ứng cộng chế tạo ra thành hợp chất no tương ứng.
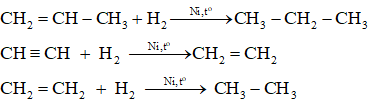
*Phản ứng cùng H2
Khi đun cho nóng có sắt kẽm kim loại niken (hoặc platin hoặc palađi) làm xúc tác, anken và ankin kết phù hợp với hiđro chế tạo thành ankan tương ứng.
Thí dụ :
Khi dùng xúc tác là các thành phần hỗn hợp Pd/Pb CO3, hoặc Pd/Ba
SO4, ankin chỉ cộng một phân tử hiđro chế tạo thành anken.
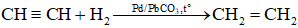
⇒ Đặc tính này được dùng để làm điều chế anken tự ankin.
*Phản ứng cộng brom
Các anken với ankin làm mất đi màu hỗn hợp nước brom.
⇒Đây là giữa những phản ứng nhận thấy hiđrocacbon ko no.
3. Mở rộng
Đa phần các bài toán về phản bội ứng cùng sẽ kết hợp cả phản ứng cộng hiđro với cộng brom.
Bài toán có dạng: Nung nóng các thành phần hỗn hợp khí X gồm H2 với hiđrocacbon ko no một thời hạn với xúc tác Ni thu được tất cả hổn hợp khí Y (thường cho thấy tỉ khối). Dẫn tất cả hổn hợp Y qua dung dịch nước brom dư.
Phương pháp giải:
+ Bảo toàn khối lượng: Mx = My
+ Bảo toàn số mol link π : Số mol liên kết
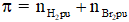
4. Bài xích tập minh họa
Bài 1 :Hỗn vừa lòng X bao gồm 0,15 mol vinylaxetilen và 0,6 mol H2. Nung nóng các thành phần hỗn hợp X (xúc tác Ni) một thời gian, thu được các thành phần hỗn hợp Y gồm tỉ khối so với H2bằng 10. Dẫn tất cả hổn hợp Y qua dung dịch brom dư, sau khi phản ứng xảy ra hoàn toàn, cân nặng brom gia nhập phản ứng là
A. 12 gam.
B. 24 gam.
C. 8 gam.
D. 16 gam.
Hướng dẫn giải
Ta có: vinylaxetilen có công thức là C4H4 ⇒có 3 liên kết π
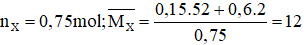
Bảo toàn khối lượng ta có:
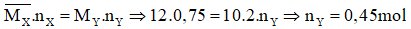
Độ giảm số mol đó là số mol cơ mà H2 bội nghịch ứng ⇒ n
H2Pu = 0,75 - 0,45 = 0,3 mol
Áp dụng bảo toàn số mol link π ta có:
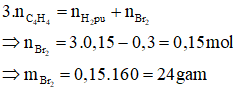
Đáp án B
Câu 2:Hỗn đúng theo khí X gồm 0,5 mol H2và 0,15 mol vinylaxetilen. Nung X một thời hạn với xúc tác Ni thu được tất cả hổn hợp Y tất cả tỉ khối so vớibằng d. Dẫn hỗn hợp Y qua hỗn hợp brom dư, sau khoản thời gian phản ứng xẩy ra hoàn toàn, cân nặng brom tham gia phản ứng là 16 gam. Quý hiếm của d là
A. 29,33.
B. 14,67.
C. 13,54.
C. 6,77.
Hướng dẫn giải
Ta có: vinylaxetilen bao gồm công thức là C4H4⇒có 3 liên kết π
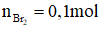
Áp dụng bảo toàn số mol links π ta có:
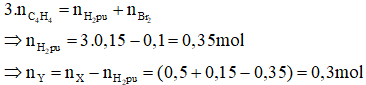
Bảo toàn khối lượng ta có:
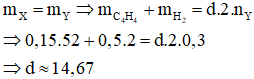
Đáp án B
Câu 3:Hỗn hợp khí A có 0,4 molvà 0,2 mol ankin X. Nung A một thời gian với xúc tác Ni thu được hỗn hợp B có tỉ khối so vớibằng 12. Dẫn các thành phần hỗn hợp B qua dung dịch brom dư, sau khi phản ứng xẩy ra hoàn toàn, khối lượng brom gia nhập phản ứng là 8 gam. Bí quyết phân tử của X là
A. C3H4
B. C2H4
C. C4H6
D. C2H2
Hướng dẫn giải
Gọi công thức tổng thể của ankin X là.Cn
H2n - 2 (n > 2)
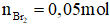
Áp dụng bảo toàn số mol link π ta có:
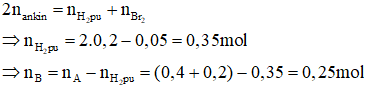
Bảo toàn trọng lượng ta có:
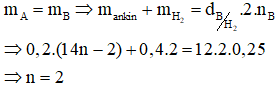
Vậy công thức phân tử của X là C2H2
Đáp án D
Giới thiệu kênh Youtube Viet
Jack
Ngân hàng trắc nghiệm miễn giá thành ôn thi THPT đất nước tại khoahoc.vietjack.com
CHỈ CÒN 250K 1 KHÓA HỌC BẤT KÌ, VIETJACK HỖ TRỢ DỊCH COVID
Tổng thích hợp các video clip dạy học từ những giáo viên giỏi nhất - CHỈ TỪ 399K tại khoahoc.vietjack.com
Công thức tính k như thế nào là chủ đề về chất hóa học mà không ít người dân quan trọng tâm và tìm hiểu. K là ký hiệu của liên kết pi. Các bạn hãy cùng tmec.edu.vn tìm làm rõ hơn về chủ đề này trong bài viết dưới đây nhé!
1. Link pi là gì?
Trong hóa học, liên kết pi (hay liên kết π) là kết liên cộng hóa trị được tạo cho khi nhì thùy của một obitan nguyên tử thâm nhập xen đậy với nhị thùy của electron orbital khác tham gia liên kết (sự xen phủ như vậy này được gọi là sự xen phủ bên của các orbital). Chỉ một trong các mặt phẳng nút của orbital đi qua cả hai hạt nhân tham gia liên kết.
Ký tự Hy Lạp π trong thương hiệu của liên kết này ám chỉ những orbital p, vì sự đối xứng orbital trong các kết liên pi cũng là sự đối xứng của các orbital lúc xét dọc theo trục liên kết. các orbital phường thường thâm nhập vào loại liên kết này. Mặc dù nhiên, những orbital d cũng có khả năng tham gia vào kết liên pi, tạo nên nên nền tảng cho kết liên bội kim khí.
Các liên kết pi thường xuyên yếu hơn những liên kết sigma do sự phân chia electron (mang điện âm) hội tụ ở xa hạt nhân nguyên tử (tích điện dương), câu hỏi này yên cầu nhiều năng lượng hơn. kết liên đôi C-C, bao gồm một liên kết sigma và một kết liên pi. Bao gồm năng lượng kết liên bằng một nửa liên kết đơn C-C, cho biết thêm tính bình ổn do một kết liên pi sản xuất yếu hơn tính định hình của một kết liên sigma. Từ ánh mắt của cơ học lượng tử, tính chất yếu của kết liên này có khả năng được giải thích bằng sự xen tủ với một chừng độ ít hơn giữa những orbital-p do định hướng đồng thời của chúng. Trái ngược với kết liên sigma, hình thành kết liên ngay tại hạt nhân nguyên tử dẫn cho độ xen phủ rộng rãi hơn.
Ngoài một kết liên sigma, một song nguyên tử kết liên qua kết liên đôi và kết liên ba tuần tự có một hoặc hai liên kết pi. K là hiệu quả của sự xen phủ những orbital nguyên tử cùng với hai diện tích xen phủ. K thường là những liên kết trải lâu năm trong vùng hơn những kết liên sigma. những electron trong các kết liên pi thường xuyên được điện thoại tư vấn là những electron pi. các mảng phân tử kết liên bởi vì một K không thể xoay loanh quanh kết liên của bọn chúng mà không có tác dụng gãy kết liên pi ấy, do vấn đề làm này hủy hoại định hướng song song của các orbital p. Cấu thành.
1.1 Những kết liên bội của kết liên pi
Đầu tiên là kết liên đôi bao gồm một liên kết sigma và một kết liên pi; ví dụ, liên ết đôi C=C trong etilen. Một liên kết ba điển hình, thí dụ là axetilen, liệt kê một liên kết sigma cùng hai liên kết pi trong hai mặt phẳng vuông góc đựng trục kết liên. Nhì là số lượng liên kết pi về tối đa có khả năng tồn tại giữa một cặp phân tử. kết liên bốn cực kì hiếm với chỉ có khả năng hình thành giữa những nguyên tử kim khí chuyển tiếp, trong những số ấy chứa một liên kết sigma, hai kết liên pi cùng một kết liên delta.

Mặc dù bản thân kết liên pi yếu rộng một liên kết sigma, song kết liên pi là thành phần cấu tạo nên các liên kết bội, thuộc với liên kết sigma. Sự liên hợp giữa kết liên pi và sigma mạnh khỏe hơn bất kì phiên bản thân một liên kết nào vào hai kết liên ấy. Sức mạnh được tăng trưởng của một liên kết bội khi đem so với một liên kết đơn (liên kết sigma) có thể được biểu hiện bằng các cách, tuy nhiên rõ rệt tuyệt nhất là vị sự co Độ dài của những liên kết. thí dụ, trong hóa học hữu cơ, kích thước kết liên cacbon–cacbon vào khoảng 154 pm trong etan, 134 pm trong etylen và 120 pm trong axetilen. Gồm nhiều kết liên khiến cho tất cả kết liên ngắn hơn và bạo dạn hơn.
1.2 trường hợp quan trọng của kết liên pi
Những kết liên pi không một mực phải kết liên các đôi nguyên tử cũng được nối kết bởi liên kết sigma.
Trong một vài phức chất của kim khí, xúc tiến pi giữa một nguyên tử kim loại và các orbital phường đối kết liên của ankin (alkyne) và anken (alkene) tạo thành nên những kết liên pi.
Trong một trong những trường hợp, trong những liên kết bội giữa hai nguyên tử, chỉ có toàn là những kết liên pi. những ví dụ kể đến diiron hexacarbonyl (Fe2(CO)6), dicarbon (C2) với borane B2H2. Trong những hợp chất này, kết liên trung trung ương chỉ gồm các liên kết pi, cùng để đã có được sự xen phủ về tối orbital tối đa, các khoảng cách kết liên phải ngắn hơn thông thường.
2. Công thức tính k
Số kết liên ππ của hợp chất hữu cơ mạch hở A, công thức Cx
Hy
Cx
Hy hoặc Cx
Hy
Oz
Cx
Hy
Oz phụ thuộc mối tương quan giữa số mol CO2CO2; H2OH2O thu được khi đốt cháy A được xem theo phương pháp sau:
A là Cx
Hy
Cx
Hy hoặc Cx
Hy
Oz
Cx
Hy
Oz mạch hở, cháy mang lại n
CO2−n
H2O=k.n
An
CO2−n
H2O=k.n
A thì A có số π=k+1π=k+1
Lưu ý: Hợp hóa học Cx
Hy
Oz
Nt
Clu
Cx
Hy
Oz
Nt
Clu gồm số πmax=2x−y−u+t+22
Trên đây, tmec.edu.vn đang giải đáp cho mình về chủ thể Công thức tính k.
Xem thêm: Hướng Dẫn Lấy Hóa Đơn Tiền Điện, Hướng Dẫn Tra Cứu, Tải Và In Hóa Đơn Điện Tử
Hy vọng những thông tin trên có ích với bạn. Cảm ơn các bạn đã đọc bài viết của bọn chúng tôi.